一、二十年打造创新药“航母”
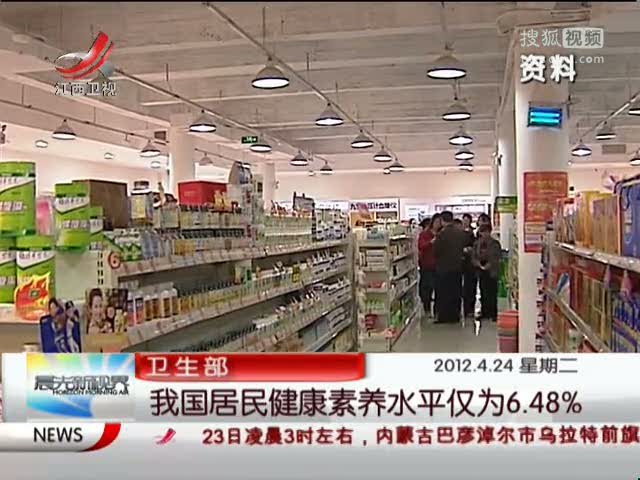
恒瑞上市以来业绩多年高速稳定增长。随着阿帕替尼、硫培非格司亭(19K)、 吡咯替尼、卡瑞利珠单抗(PD-1)、瑞马唑仑等重磅专利药接连上市。我们认为公司已 经充分证明其创新研发实力,研发后期的产品管线丰富,随着公司进一步证明自己的创 新能力,估值有望再次打开空间。
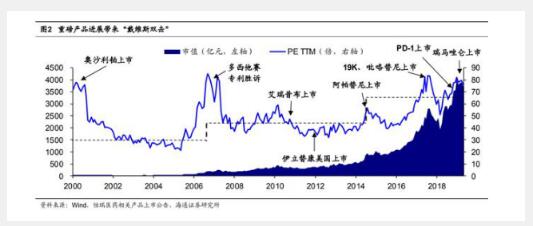
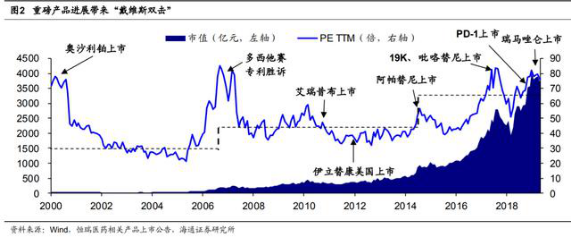
国内收入远未到天花板 恒瑞国内收入远未到天花板。根据 IQVIA,2018 年中国药品市场规模估计 14040 亿元,而恒瑞 2018 年国内营收 167.5 亿元,仅占整体市场的 1.2%;同年美国药品市场 规模 4849 亿美元,TOP3(辉瑞、罗氏、强生)企业的渗透率分别在 4.8%-5.2%之间。
假设中国药品市场规模年均增长 4.5%,且恒瑞等头部药企渗透率达到 5%,则 2028 年中国药品市场规模将达到 21804 亿元,恒瑞国内营收达到 1090 亿元——在新产品持 续获批、集中度提升情况下,恒瑞仅靠国内营收增量, 2018-2028 年年均复合增长率 就可保持在 21%左右。
二、海外临床崭露头角,专利授权双管齐下
中国数据助力海外临床,重磅创新药成出海排头兵。我们认为公司创新药中国试验 的数据将有助于海外临床更快开展、节约临床试验费用,公司海外临床进展最快的 PD-1 单抗卡瑞利珠、阿帕替尼和吡咯替尼均已在国内上市
卡瑞利珠单抗联合阿帕替尼一线治疗肝细胞癌的国际多, III 期临床有望在美国、 欧洲和中国同步开展,FDA 同意公司在无进展生存期(PFS)期中分析达到预设统计学 标准时提前申报生产。由于罗氏针对 HER2+乳腺癌的布局十分完善,吡咯替尼并未选择 国内获批的 HER2+乳腺癌适应症,而是推进 HER2+非小细胞肺癌的海外临床。
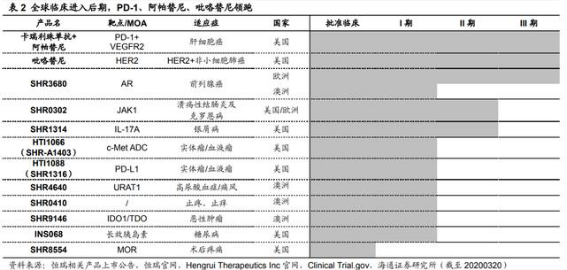
自主研发海外授权验证创新实力。公司通过出让自主研发的 BTK 抑制剂、JAK1 抑 制剂海外权益获得一定现金流与未来销售分成,我们认为成功的 license-out 经验验证了 公司的自主研发实力。
三、新药获批临床,创新水平跻身国际前列
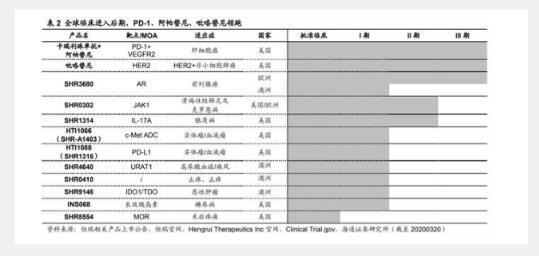
近期多款新药获批临床,在研新药临床深度开发。根据公司公告,在 研新药 SHR5126 片获 CDE 批准开展临床研究。SHR5126 是一种新 型、强效、高选择性的口服 A2AR 拮抗剂,拟用于治疗实体瘤患者; 目前全球在研的口服 A2AR 拮抗剂仅三个,进展最快的 PBF-509 刚进 入 II 期;公司在早期研发项目上已经逐渐居于全球前列甚至,位置。
艾瑞卡授权韩国 CG 公司,创新药再获国际认可。近年来,公司在研 项目 SHR1459、SHR1266 等陆续授权给国际药企;近日,与韩国 CrystalGenomics Inc.公司(CG 公司)达成协议,将具有自主知识产 权的艾瑞卡有偿许可给韩国 CG 公司,CG 公司将向恒瑞支付 150 万 美元的首付款和累计不超过 150 万美元的里程碑款,以及累计不超过 8425 万美元的销售里程碑付款。
创新实力跻身国际前列,静待新药国际化结果。近日,英国医药资讯 公司IDEA Pharma发布2020年医药创新指数和医药发明指数排行榜, 恒瑞医药,上榜,分别位列第 13 位和第 15 位,并且是,上榜的 中国制药企业。早在 2010 年以前,公司即尝试将研发的创新药推向欧 美市场,十余年来不断积累,目前包括吡咯替尼、SHR0302 等多个项 目在欧洲/美国开展 II 期临床研究。